歩行のリズムを生み出す神経回路:Central Pattern Generator (CPG) の最新知見 2025年版
私たちが普段何気なく行っている「歩く」という動作は、実は非常に精巧な神経メカニズムによって制御されています。その中心的な役割を担っているのが、Central Pattern Generator (CPG) と呼ばれる神経回路網です。CPGは、脳からの指令や感覚情報がなくても、リズミカルな運動パターン(歩行のような)を自律的に生成する能力を持っています。本稿では、主に脊髄に存在すると考えられている歩行CPGの基本的な仕組みと、近年の研究によって明らかになってきた新しい知見、そしてリハビリテーションへの応用について解説します。
CPGとは何か?
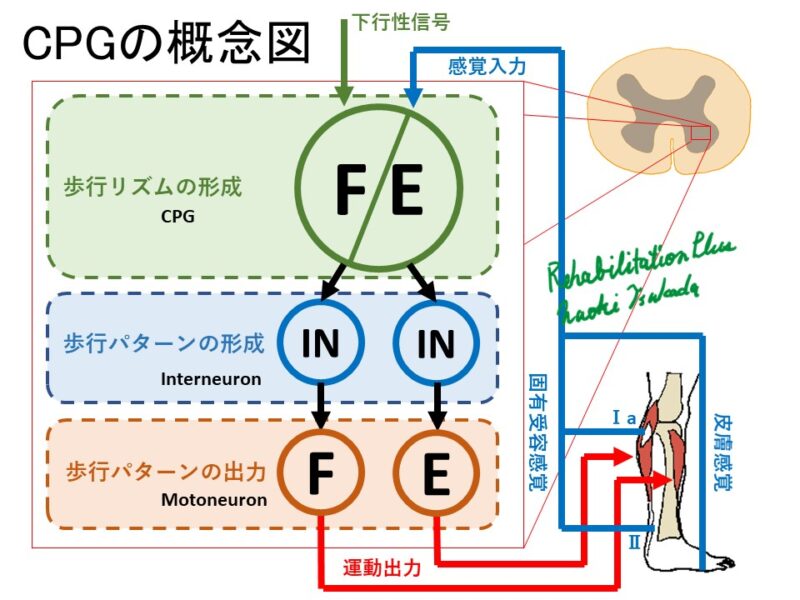
CPGは、脳からの持続的な指令や末梢からの感覚フィードバックなしに、周期的な運動指令を生成できる脊髄(または脳幹)内のニューロンネットワークです [1]。歩行においては、左右の脚の協調した動きや、屈筋(脚を曲げる筋肉)と伸筋(脚を伸ばす筋肉)の交互の活動パターンなどを生み出す基盤となっています。この基本的なリズム生成能力により、私たちは意識せずともスムーズな歩行を行うことができます。
CPGの基本的な仕組みと近年の進展
CPGの存在は、古くは除脳ネコを用いた実験などで示唆されてきました。脊髄が脳から切り離されても、トレッドミルの上を歩かせると、適切な感覚入力があれば歩行様の運動が誘発されることが確認されています。
CPGの本体は、脊髄の介在ニューロン(インターニューロン)の複雑なネットワークであると考えられています。これらのニューロンが相互に接続し、興奮性と抑制性の信号をやり取りすることで、リズミカルな発火パターン、すなわち歩行のリズムが生み出されます。近年の研究では、遺伝学的な手法や光遺伝学(オプトジェネティクス)などを用いて、CPGを構成する特定の介在ニューロン群の同定とその機能の解明が進んでいます [2]。例えば、V0、V1、V2a、V3といった発生学的に分類されるニューロン群が、それぞれ左右の協調、屈筋・伸筋の交互活動、リズム生成の安定性などに特定の役割を果たしていることがマウスなどの動物モデルで明らかにされつつあります [1, 3]。これらのニューロン群がどのように相互作用し、安定した歩行リズムを作り出すのか、その詳細な回路メカニズムの解明が精力的に進められています。
CPGの活動はどのように調整されるか?
CPGは自律的にリズムを生成できますが、実際の歩行は状況に応じて巧みに調整されます。この調整には、大きく分けて二つの要素が関与します。
感覚フィードバック
足裏からの接地感覚や、筋肉・腱からの固有受容感覚(手足の位置や動きの感覚)などの末梢からの感覚情報は、リアルタイムで脊髄CPGに入力されます。これにより、路面の変化に対応したり、つまずきそうになった時に素早く姿勢を立て直したり(つまずき補正反射)するなど、歩行パターンが状況に合わせて微調整されます [3, 4]。最近の研究では、特定の感覚入力がCPG内のどのニューロン群に作用し、どのように歩行リズムを変調するのか、その具体的な経路も少しずつ明らかになっています [4]。
脳からの下降性制御
歩行の開始や停止、速度の変更、方向転換、あるいは障害物を避けるといった意図的な制御は、脳からの指令によって行われます。特に、脳幹の中脳歩行誘発野(Mesencephalic Locomotor Region: MLR)は、歩行の開始と速度調節に重要な役割を果たすことが知られています [5]。MLRからの信号が脊髄のCPGネットワークを活性化し、その活動レベルに応じて歩行速度が変化します。大脳皮質や小脳なども、より高次な歩行のプランニングやバランス制御に関与し、CPGの活動を精密に調整しています。近年の研究では、これらの下降性経路が、CPGを構成する特定の介在ニューロン群を選択的に制御することで、多様な歩行パターンを実現している可能性が示唆されています [5]。
CPGとリハビリテーションへの応用
CPGの概念は、特に脊髄損傷(Spinal Cord Injury: SCI)後のリハビリテーションにおいて重要視されています。脊髄損傷によって脳からの下降性指令が遮断されても、損傷部位より下の脊髄に存在するCPGネットワーク自体は温存されている場合があります。そのため、CPGを適切に賦活(活性化)することができれば、失われた歩行機能を部分的にでも回復できる可能性があります。
伝統的なリハビリテーションとして、免荷式トレッドミル歩行(BWSTT)などがあります。これは、体重の一部を免荷した状態でトレッドミル上を歩行する訓練であり、足底への適切な刺激と股関節の伸展による感覚フィードバックを通じて、脊髄のCPGを賦活することを狙いとしています。
さらに近年では、硬膜外電気刺激(Epidural Electrical Stimulation: EES)を用いた治療法の開発が目覚ましい進歩を遂げています [6, 7]。これは、脊髄の硬膜外腔に電極を埋め込み、CPGが存在するとされる腰仙髄領域を持続的または周期的に刺激するものです。最近の研究では、単に刺激するだけでなく、歩行周期に合わせて時空間的にパターン化された刺激(Spatiotemporal EES)を与えることで、より自然で機能的な歩行運動を誘発できることが示されています [6, 7]。一部の完全麻痺の患者さんにおいても、EESと集中的なリハビリテーションを組み合わせることで、刺激なしでも限定的ながら随意的な歩行が可能になったという報告もあり、CPGをターゲットとした神経リハビリテーションの新たな可能性を示しています [7]。将来的には、EESとブレイン・マシン・インターフェース(BMI)などを組み合わせ、患者の意図に応じて刺激パターンを制御するような、より高度な治療法の開発も期待されています。
総合的にみていくことが重要ですが、今回の記事の内容からいくつかのアイデアをまとめてみます。
下行性信号に着目して
頭の傾きや身体アライメントなどをただし、傾きや倒れる感覚を極力減らすことが重要です。時にBWSSやスリングのような器具が有効な時もあると思います。
ゆっくりと歩くことは一側の立脚時間が長くなり慣性が生じにくくなります。健常成人でもゆっくり歩くことはふらつくことがあります。そこで、2人がかりで歩行を解除してスピードやリズムを経験していただくことも有用なことがあります。
感覚フィードバックに目を向けて
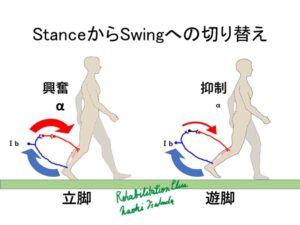
感覚フィードバックに着目すると、下肢が支持している感覚のフィードバックが重要と言えます。特に立脚中の足底からの皮膚感覚や新筋群からのⅠa、Ⅰb情報などの固有需要感覚は脚の支持状態を認識するために重要です。
立脚側の伸筋の長さ(筋紡錘からのⅠa求心情報)と腱の張力(腱紡錘のⅠb求心情報)は立位で伸筋が不活性になっていないか確認してみると良いと思います。
装具はどうか?
足関節など固定している装具ではいくつかの問題があります。踵接地後に下腿が後方から押され、膝折れの感覚フィードバックになるなどです。これは、CPGにとっては歩行を停止すると判断する情報になりかねません。
ですが、立脚の際の全体の抗重力伸展の練習など、適用場面を選択することでリハビリを進めやすくなることや、安定感を得ることで歩く経験を重ねられるというメリットもあります。
まとめ
歩行CPGは、脊髄に存在する自律的なリズム生成回路であり、私たちの基本的な歩行運動の基盤を形成しています。その活動は、末梢からの感覚フィードバックと脳からの下降性指令によって巧みに調整されています。近年の研究により、CPGを構成する具体的なニューロンネットワークや、その調節メカニズムの理解が深まっています。これらの知見は、歩行障害に対する新たなリハビリテーション戦略において多角的な視点を持ったアプローチの重要性を示唆していると考えています。
以上、歩行時のCPGの役割についてまとめてみました。CPGはあくまでも歩行の一側面を担っているにすぎず、CPGだけに注目した歩行練習というのでは機能的な歩行にならないことを最後に追記しておきます。
参考文献
[1] Kiehn, O. (2016). Decoding the organization of spinal circuits that control locomotion. Nature Reviews Neuroscience, 17(4), 224-238. (※少し古いですが、CPG研究の基礎を理解する上で非常に重要な総説です。ここ5年以内の論文の基礎となっています)
[2] Gosgnach, S., Bikoff, J. B., Dougherty, K. J., El Manira, A., Lanuza, G. M., & Zhang, Y. (2017). V0 interneurons coordinate limbed locomotion with breathing. Neuron, 95(5), 1167-1178.e6. (※これは呼吸との協調に関する例ですが、特定の介在ニューロンの機能解明の一例として)
[3] Danner, S. M., Zhang, H., Shevtsova, N. A., & Rybak, I. A. (2019). State-dependent signaling in spinal cord locomotor command pathways. Current Opinion in Physiology, 8, 82-90.
[4] Takeoka, A., & Arber, S. (2019). Functional Local Proprioceptive Input to Motor Pools Formed by Renshaw Cell Neuromodulation. Cell, 177(3), 749-763.e18.
[5] Jordan, L. M., & Rybak, I. A. (2022). Neural Control of Locomotion: Systems, Circuits, and Neurorehabilitation. Comprehensive Physiology, 12(1), 3061-3137. (※包括的な総説で、MLRなど下降性制御に関する近年の知見も含まれます)
[6] Wagner, F. B., Mignardot, J. B., Le Goff-Mignardot, C. G., Demesmaeker, R., Komi, S., Capogrosso, M., … & Courtine, G. (2018). Targeted neurotechnology restores walking in humans with spinal cord injury. Nature, 563(7729), 65-71.
[7] Rowald, A., Komi, S., Demesmaeker, R., Baaklini, E., Hernandez-Charpak, S. D., Paoles, E., … & Courtine, G. (2022). Activity-dependent spinal cord neuromodulation rapidly restores trunk and leg motor functions after complete paralysis. Nature Medicine, 28(2), 260-271.